烯基含氟砌块研究
简介
由于氟原子半径小,且具有最强的电负性(4.0),引入氟原子后对C-F键极性方向和整个分子的电子云分布均会发生变化,影响分子的偶极矩、酸碱性等,进而影响整个分子的物理性质和化学性质。
氟原子或含氟基团的引入通常还会增加分子的脂溶性和疏水性,提高药物分子的溶解度,促进药物的传导和吸收。所以很多含氟药物或者农药相对具有用量少、毒性低、药效高等特点,这使得含氟药物或农药所占比例越来越高。
在各种含氟砌块中,烯基含氟砌块是非常重要的生物活性分子结构,具有各种药理活性(如抗癌、抗菌、抗艾滋病毒、抗糖尿病),还可以作为合成砌块用于制备不同的含氟官能团。
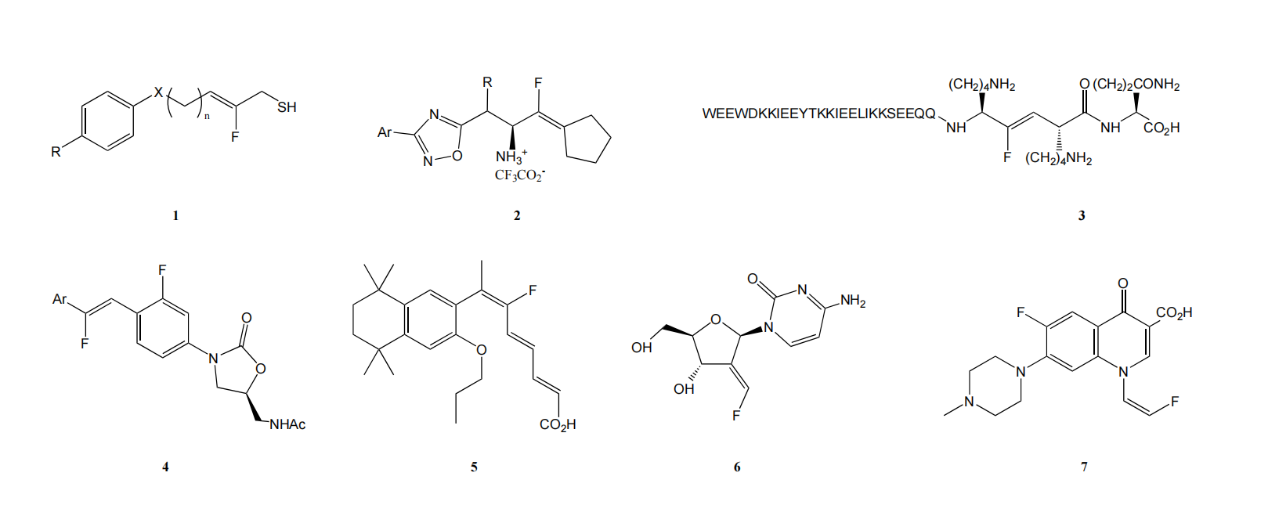
图1. 具有生物活性的烯基含氟砌块
1.HDAC抑制剂(histone deacetylase inhibitors)——抗癌
2.DPP-4抑制剂(Dipeptidyl peptidase 4 inhibitors)——抗2型糖尿病
3.HIV融合抑制剂(HIV fusion inhibitor)——抗艾滋病毒药物
4.蛋白合成抑制剂 (Protein synthesis inhibitors)——抗菌药物
5.视黄醇X受体调节剂(Retinoid X receptor regulator )——抗2型糖尿病
6.核糖核苷酸还原酶抑制剂(Ribonucleotide reductase inhibitor)——抗癌
7.DNA回旋酶抑制剂(DNA gyrase inhibitor)——抗菌药物
合成方法
1. 烯化反应
2-氟-2-膦酰基乙酸三乙酯(Triethyl 2-fluoro-2-phosphonoacetate)和氟甲基苯基砜(Fluoromethyl phenyl sulfone)是比较经典的单氟砌块。
2-氟-2-膦酰基乙酸三乙酯通常由膦酰基乙酸三乙酯通过亲电氟化试剂氟化合成,其可以在碱作用下与醛酮化合物经由膦叶立德中间体制得α-氟-α,β-不饱和羧酸酯 。其中,醛羰基反应活性高于酮羰基反应活性,同时还具有更好的顺反选择性。(方案1)
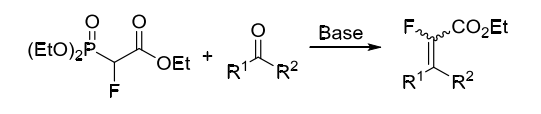
方案1. 2-氟-2-膦酰基乙酸三乙酯作为含氟砌块
1994年,Patrick课题组报道甘油醛和2-氟-2-膦酰基乙酸三乙酯在丁基锂作用下E式单一产物[1]。(方案2)
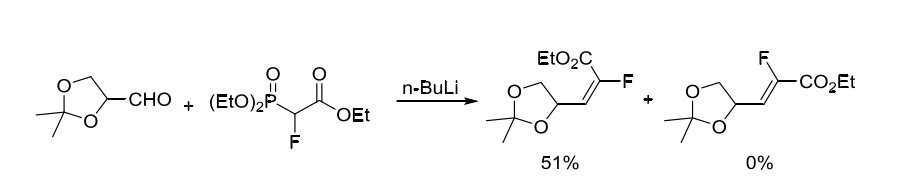
方案2. 2-氟-2-膦酰基乙酸三乙酯作为含氟砌块
Gernert课题组也在2003年使用2-氟-2-膦酰基乙酸三乙酯与酮羰基化合物反应合成氟化产物,但产物是不具有顺反选择性的[2]。(方案3)
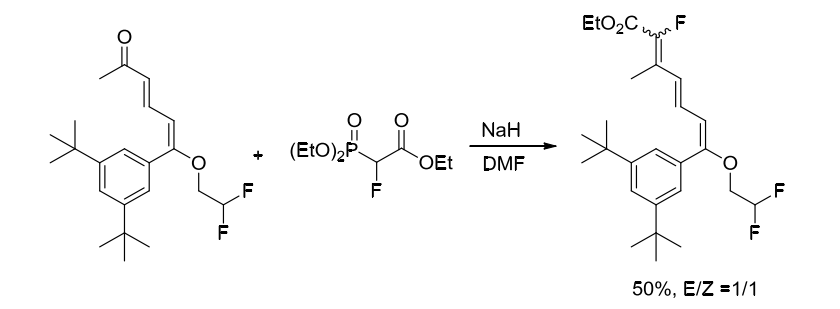
方案3. 使用含氟砌块2-氟-2-膦酰基乙酸三乙酯合成氟化烯烃
上文提到的氟甲基苯基砜近年来也被作为被经常使用的含氟砌块。在1985年,McCarthy课题组早在1985年研究了其制备方法,反应性质以及反应机理。氟甲基苯基砜首先会与丁基锂反应生成氟甲基苯基砜锂盐中间体,然后直接与芳香醛反应得到相应的α-氟-β-羟基砜化合物。该化合物再通过脱去砜基以形成单氟末端烯烃[3-5]。(方案4)
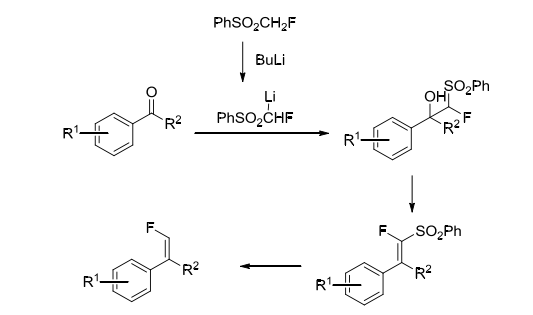
方案4. 氟甲基苯基砜作为含氟砌块
2.消除反应
消除反应是制备α-取代的α-氟烯烃的常用方法。为了将末端烯烃转化为它们的氟化当量,卤化反应和消除反应被广泛使用
[6]。(方案5)。
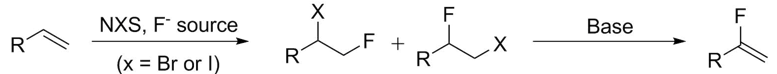
这种消除过程通常被认为是SN2反应的竞争过程,特别是当存在强碱时。它可以发生在一级、二级和三级底物上。除非使用特殊的非亲核胺碱,否则强碱存在下的初级底物通常只会产生取代。
用具有强碱和胺碱的二级和三级底物很容易消除。消除是二级的,取决于底物和碱浓度。碱需要在一步过程中攻击β-氢。
大多数E2反应提供取代最多的烯烃作为主要异构体,但可能使用的条件会改变区域选择性。形成更多取代的烯烃称为Saytzeff消除。反应的区域选择性受碱的性质影响很大。大的叔丁醇碱太大而不能攻击内部CH2基团,从而攻击CH3基团。甲醇比叔丁醇更小,对CH2基团的攻击更大,但主要产物仍然是1-烯烃。
几乎所有的消除反应都产生烯烃混合物,而不是一种清洁的产物。反应由产物的稳定性(和过渡态)决定,因此烯烃的稳定性差异很小。取代度高的烯烃比取代度低的烯烃更稳定,但能量差很小。
此外,当E和Z烯烃异构体可能存在时,主要异构体是E异构体,但Z异构体通常存在一定程度。
3.交叉偶联反应
在金属催化交叉偶联领域,Heck反应是烯烃芳基化的一种非常方便的方法。在大多数情况下,乙烯基的氢原子被有机卤化物的有机残基取代。当使用不对称取代的烯烃时,由于空间位阻决定的高区域选择性,导致在较少取代位点发生烯烃芳基化。反应的关键步骤之一是β-氢化物消除。
1991年,Heitz和Knebelkamp试图从芳基碘化物和偏二氟乙烯合成β,β-二氟苯乙烯。在乙酸钯催化作用下,如果β-氢化物消除是必要的反应步骤,β,β-二氟苯乙烯应该是唯一的反应产物。而β,β二氟苯乙烯在这些反应中仅作为副产物形成。第一次发现了在Pd(OAc)2催化条件下使芳基碘化物与1,1-二氟乙烯反应来获得α-氟乙烯衍生物的一步反应[7]。(方案6)
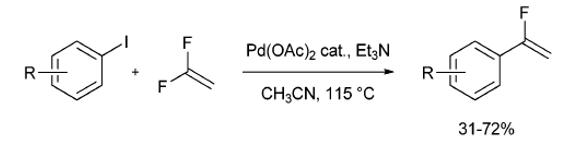
4.亲电氟化
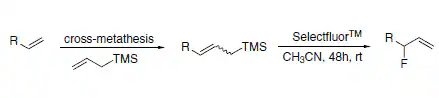
Pacheco和Gouverneur研究了烯丙基甲基硅烷在Selectfluors反应条件下的反应性,以便在不使用氟化构建块的情况下进行亲电氟脱硅反应制备氟二烯怕[8]。(方案7)
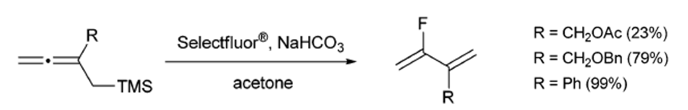
其中,Selectfluor氟化试剂(N-氟-N'-(氯甲基)三乙二胺双(四氟硼酸盐)或F-TEDA)是一种用户友好性的、温和的、在空气和水分状况下稳定的、非挥发性的亲电氟化反应剂。Selectfluor氟化试剂能够在一个步骤内将氟引入有机底物,具有非常广泛的反应范围[9]。这些反应中,绝大多数都表现出了优异的区域选择性。
烯丙基氟化物可以通过交叉复分解反应/亲电氟脱硅路线制备(方案8)。这种途径避免了使用DAST进行亲核置换或开环反应时烯丙基转位产生的副产物的形成[10]。
应用
目前含氟砌块已经在医药、农药、染料、表面活性剂、氟碳材料、航空航天等各种化工领域得到广泛应用。
其中,烯基含氟砌块在材料科学和合成有机化学中具有潜在的应用,可以用作氟化合成子进行进一步的功能化。此外,氟化烯基可以作为肽键同工酶用于药物化学,这为寻找新的生物活性化合物开辟了新的机会。
参考文献
1.Patrick, T. B.; Lanahan, M. V.; Yang, C.; Walker, J. K.; Hutchinson, C. L.; Neal, B. E., J. Org. Chem.1994,59, 1210.
2. Gernert, D. L.; Ajamie, R.; Ardecky, R. A.; Bell, M. G.; Leibowitz, M. D.; Mais, D. A.; Mapes, C. M.; Michellys, P. Y.; Rungta, D.; Reifel-Miller, A.; Tyhonas, J. S.; Yumibe, N.; Grese, T. A., Bioorg. Med.
Chem. Lett.2003,13, 3191.
3. McCarthy, J. R.; Peet, N. P.; LeTourneau, M. E.; Inbasekaran, M., J. Am. Chem. Soc.1985,107, 735.
4. McCarthy, J. R.; Peet, N. P.; LeTourneau, M. E.; Inbasekaran, M., J. Am. Chem. Soc.1985,107, 735.
5. McCarthy, J. R.; Huber, E. W.; Le, T.-B.; Mark Laskovics, F.; Matthews, D. P., Tetrahedron 1996,52, 45.
6. Takeuchi Yoshio,Yamada Asuka,Suzuki Takanori,Koizumi Toru. Synthetic studies towards proline amide isosteres, potentially useful molecules for biological investigations[J]. Tetrahedron,1996,52(1).
7. Walter Heitz,Arno Knebelkamp. Synthesis of fluorostyrenes via palladium‐catalyzed reactions of aromatic halides with fluoroolefins[J]. Macromolecular Rapid Communications,1991,12(2).
8. Furuya Takeru,Ritter Tobias. Fluorination of boronic acids mediated by silver(I) triflate.[J]. Organic letters,2009,11(13).
9. Singh, R. P. , Shreeve, J. M.. 2004. For a review of recent highlights: Acc. Chem. Res..37, 31.
10. Thibaudeau S, Gouverneur V. 2003. Sequential Cross-Metathesis/Electrophilic Fluorodesilylation:? A Novel Entry to Functionalized Allylic Fluorides. Org. Lett.. 5(25):4891-4893.
这有帮助吗? 是 否 第一个投票!
标签:
烯基含氟砌块 烯化反应 消除反应 交叉偶联反应 亲电氟化
相关产品列表
-
P122285 (全氟己基)乙烯 ,98%SDS| 价格
-
P122287 1H,1H,2H-全氟-1-癸烯 ,98%SDS| 价格
-
P122288 1H,1H,2H-全氟-1-十二烯 ,97%SDS| 价格
-
P122284 1H,1H,2H-全氟-1-己烯 ,97%SDS| 价格
-
D120764 反式-2,5-二氟肉桂酸 ,98%SDS| 价格
-
F102168 对氟肉桂酰氯 ,97%SDS| 价格
-
A151406 烯丙基五氟苯 ,>98.0%(GC)SDS| 价格
-
S101457 N-氟-N'-(氯甲基)三乙二胺双(四氟硼酸盐) ,95%SDS| 价格
-
T140253 2-氟-2-磷酰基乙酸三乙酯 ,≥96%SDS| 价格
-
T162738 反-2,6-二氟肉桂酸 ,>95.0%(GC)SDS| 价格
-
D120765 反式-3,4-二氟肉桂酸 ,98%SDS| 价格

 订购客服热线
订购客服热线













 营业执照(三证合一)
营业执照(三证合一)  危险品化学品经营许可证(不带存储)
危险品化学品经营许可证(不带存储) 
